
|
PIT00271 Контроль микробиомов хозяином С биологической точки зрения, точного ответа на вопрос "кто в теле хозяин?" - нет! Но с исторической или социальной точки зрения часто предполагают в гипотезе стволового развития, что более сложный объект хозяин для менее сложного. С точки зрения сетевого развития симбиозов хозяина никогда нет. Есть даже более сильное утверждение, что биологическим хозяином в симбиозе является самый опытный и самый "пронырливый" участник симбиоза, т.е. E.coli и "иже с ними". Не будем пока заморачиваться на этом. Свежая новость {Liu2016} Shirong Liu, Andre Pires da Cunha, Rafael M. Rezende, Ron Cialic, Zhiyun Wei, Lynn Bry, Laurie E. Comstock, Roopali Gandhi, and Howard L. Weiner. The Host Shapes the Gut Microbiota via Fecal MicroRNA // Cell host & microbe 19 (1), 32-43 (2016). doi 10.1016/j.chom.2015.12.005 (сама статья пока никак недоступна!) "с колёс" рассмотрена в BioTechniques Kristie Nybo. How Hosts Control Their Microbiomes где приведен рисунок из аннотации статьи [Liu2016] 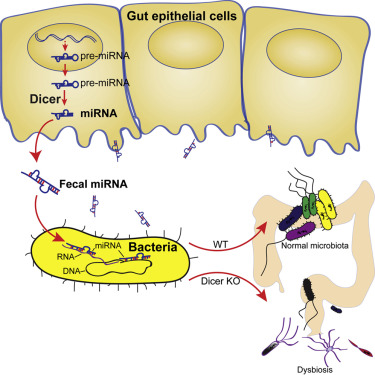 и сказано следующее. Так как микробы кишечника играют важную роль в обмене веществ, в иммунитете и при болезнях, важно понять механизмы, с помощью которых микрофлора регулируется хозяином, и определить пути, которыми можно манипулировать микробиомом. Предыдущие исследования показали, что кишечные микробы, пересаженные из рыбы в зародыши мышей, скорее напоминает нормальную микрофлору мыши, что указывает на то, что мышиный зародыш формирует состав своих кишечных бактерий. Вайнер (Weiner) и его коллеги задались целью выяснить, как это происходит, и сообщили в журнале [Liu2016] следующее. "Наши результаты показывают, что механизм защиты организма состоит в выделении микроРНК в качестве стратегии для манипуляций микробиомом для здоровья хозяина", сказал он. Команда определила, что микроРНК создаются эпителиальными клетками кишечника и бокаловидными клетками, а затем секретируется в просвет кишечника с помощью внеклеточных пузырьков. Как ни странно, взаимодействия не всегда приводят к разрушению бактериальной мРНК, как это происходит обычно для микроРНК; вместо этого микроРНК увеличили присутствие некоторых транскриптов и способствовали росту бактерий. Приведу основные моменты и аннотацию статьи, что позволяет лучше понять рисунок http://www.cell.com/cell-host-microbe/abstract/S1931-3128(15)00497-7 Highlights Summary Peter Belobrov 30 Jan 2016 06:20
© International Open Laboratory for Advanced Science and Technology — MOLPIT, 2009–2026
|