
|
PIT00378 Все этапы клеточного цикла вместе Хорошо отлаженная за 8 лет популярная техника визуализации клеточного цикла методом флюоресценции убиквитинового индикатора клеточного цикла (Fucci = Fluorescence Ubiquitin Cell-cycle Indicator) помогла получить одновременно изображения всех 4-х фаз (G1, S, G2, M) клеточного цикла [Bajar2016]. 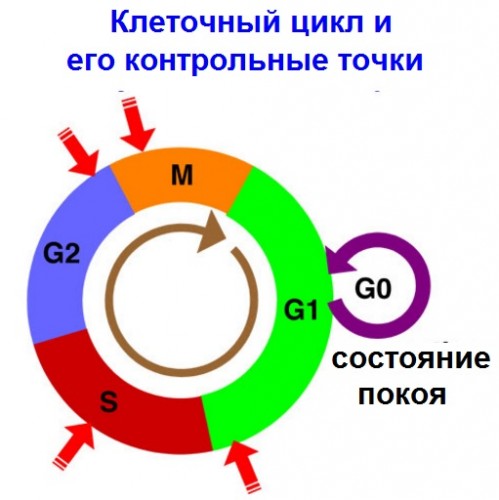 Фазы G1, S, G2, M и G0 клеточного цикла. Подробнее в PIT00370 Убиквитин (первоначально названный ubiquitous immunopoietic polypeptide — повсеместно встречающийся полипептид, ответственный за иммунопоэз) впервые был идентифицирован в 1975 году как белок с неизвестной функцией и присутствующий во всех эукариотических клетках. В 2004 году Аарон Чехановер, Аврам Гершко и Ирвин Роуз были удостоены Нобелевской премии по химии «за открытие убиквитин-опосредованной деградации белка». Убиквитин (от англ. ubiquitous — вездесущий) — небольшой (8.5 кДа) консервативный белок эукариот, участвующий в регуляции процессов внутриклеточной деградации других белков, а также их функций. Он присутствует почти во всех тканях многоклеточных эукариот, а также у одноклеточных эукариотических организмов. {Bajar2016} Bryce T. Bajar, Amy J. Lam, Ryan K. Badiee, Young-Hee Oh, Jun Chu, Xin X. Zhou, Namdoo Kim et al. Fluorescent indicators for simultaneous reporting of all four cell cycle phases // Nature Methods 13 (12), 993-996 (2016). doi 10.1038/nmeth.4045 Аннотация. Надежный метод для одновременного визуализации всех четырех фазах клеточного цикла в живых клетках является весьма желательным. Мы разработали интенсиометрический (измерение интенсивности) репортер перехода от S к G2 фазе и инженерный флуоресцентный (в дальней красный области) белок, mMaroon1, позволяющий визуализировать конденсацию хроматина в митозе. Мы объединили эти новые репортеры с ранее описанной системой Fucci для создания Fucci4. Этот набор из четырех ортогональных показателей флуоресценции позволяет вместе увидеть все фазы клеточного цикла. 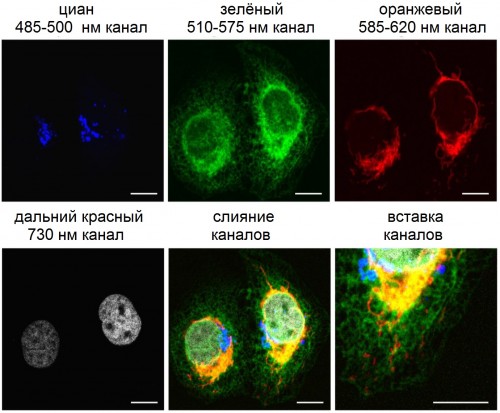 Рис. S6. [Bajar2016] Fucci4 изображения с CFP, GFP, OFP и mMaroon1. Одновременные конфокальные изображения экспрессии MannII-10aa-mTurquoise2 (аппарат Гольджи), калнексин-14AA-Clover (эндоплазматический ретикулум), PDHA-10aa-mKO2 (митохондрии) и H1.0-10aa-mMaroon1 (ядро) клеток U2OS в четырех каналах. Каналы определяются следующим образом -- циан, 440 нм возбуждение, 460-500 нм излучение; зеленый, 488 нм возбуждение, 500-550 нм излучение; оранжевый, 559 нм возбуждение, 570-670 нм излучение; дальний красный, 635 нм возбуждение, 650-750 нм излучение. Обратите внимание, в то время как слияние калнексина и PDHA показывают некоторые перекрывающиеся распределения в около ядерных областях, некоторые PDHA сигналы появляется в областях, не имеющих калнексиновых сигналов, и наоборот, что указывает на неполной перекрытие. Шкала - 10 мкм. Понимание приведенного рисунка станет понятнее после просмотра трёх видео, прилагаемых к статье [Bajar2016]. Видео 1. Отслеживание фаз клеточного цикла с помощью микроскопии живых клеток HeLa человека с использованием флуоресцентного метода Fucci4. (3.38 MB, Скачать). Видео 2. Отслеживание фаз клеточного цикла с помощью микроскопии живых клеток мыши NIH3T3 с использованием флуоресцентного метода Fucci4. (9.88 MB, Скачать). Видео 3. Отслеживание фаз клеточного цикла с помощью микроскопии живых клеток HeLa человека с использованием флуоресцентного метода Fucci4. (6,64 MB, Скачать). Для ясности спектральные цвета показаны на рисунке. 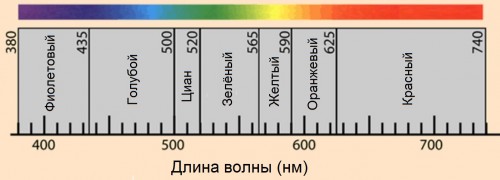 Спектральные цвета. Применительно к жизни растений принято красный свет делить на просто красный (660 нм) и дальний красный (730 нм). В реферате "визуализация всех фаз клеточного цикла" работы [Bajar2016] были даны ссылки на основные статьи по созданию и развитию метода Fucci. Прилежно воспроизвожу их ниже в том же порядке с указанием числа цитирований на 12/1/2017. {Sakaue-Sawano2008c} Asako Sakaue-Sawano, Hiroshi Kurokawa, Toshifumi Morimura, Aki Hanyu, Hiroshi Hama, Hatsuki Osawa, Saori Kashiwagi et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression // Cell 132 (3), 487-498 (2008). doi 10.1016/j.cell.2007.12.033 Cited by 848 {Sakaue-Sawano2008} Asako Sakaue-Sawano, Kenji Ohtawa, Hiroshi Hama, Masako Kawano, Masaharu Ogawa, and Atsushi Miyawaki. Tracing the Silhouette of Individual Cells in S/G 2/M Phases with Fluorescence // Chemistry & biology 15 (12), 1243-1248 (2008). doi 10.1016/j.chembiol.2008.10.015 Cited by 48 {Zielke2011} Norman Zielke, Kerry J. Kim, Vuong Tran, Shusaku T. Shibutani, Maria-Jose Bravo, Sabarish Nagarajan, Monique Van Straaten et al. Control of Drosophila endocycles by E2F and CRL4CDT2 // Nature 480 (7375), 123-127 (2011). doi 10.1038/nature10579 Cited by 62 {Zielke2014} Norman Zielke, Jerome Korzelius, Monique van Straaten, Katharina Bender, Gregor FP Schuhknecht, Devanjali Dutta, Jinyi Xiang, and Bruce A. Edgar. Fly-FUCCI: A versatile tool for studying cell proliferation in complex tissues // Cell reports 7 (2), 588-598 (2014). doi 10.1016/j.celrep.2014.03.020 Cited by 34 {Chittajallu2015} Deepak R. Chittajallu, Stefan Florian, Rainer H. Kohler, Yoshiko Iwamoto, James D. Orth, Ralph Weissleder, Gaudenz Danuser, and Timothy J. Mitchison. In vivo cell-cycle profiling in xenograft tumors by quantitative intravital microscopy // Nature methods 12 (6), 577-585 (2015). doi 10.1038/nmeth.3363 Cited by 25 Peter Belobrov 12 Jan 2017 08:00
© International Open Laboratory for Advanced Science and Technology — MOLPIT, 2009–2026
|