
|
PIT00414 Секреты тотипотентных клеток Как тотипотентная клетка умудряется сохранить потенциал, чтобы стать любой из более чем 200 типов клеток в организме человека, является давней загадкой в биологии. Словами Тимофеева-Ресовского это ключевой момент основной биологической проблемы "как проблемы передачи наследственной информации от поколения к поколению и реализации этой информации в каждом поколении. В сущности, такая формулировка покрывает всю основную проблематику биологии" (источник и точную цитату см в PIT00356). Существенное продвижение в разгадке этого секрет сделано в недавно опубликованной работе [Flyamer2017]. Для понимания отношения этого поста к родословной клеток полезно посмотреть более ранние посты PIT00069, PIT00070, PIT00220 и PIT00259. В статье [Flyamer2017] среди авторов исследователи из команды Сергея Владимировича Разина. Без хотя бы одноразового чтения книги С. В. Разин, А. А. Быстрицкий. Впервые в мире продемонстрировано, что фрагмент ДНК, картированный в качестве петли с использованием биохимического подхода, действительно образует петлю, которая может быть визуалирована на цитологических препаратах. На примере домена альфа-глобиновых генов кур изучены основные принципы работы геномных доменов открытого типа, которые не имеют четких границ и могут содержать перекрывающиеся ткане-специфичные гены и гены домашнего хозяйства. Обоснована гипотеза, постулирующая, что эволюция генома может происходить посредством делеций, дупликаций и перемещений топологических петель ДНК. Для более популярного изложения сути дела полезен пресс-релиз Института молекулярной биотехнологии Академии наук Австрии "Уникальная архитектура генома после оплодотворения в одноклеточный эмбрионах", из которого взята картинка с подписью ниже. 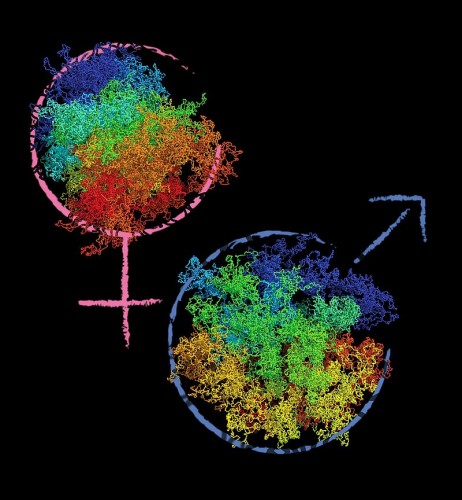 Слияние яйца и спермы, двух высокодифференцированных типов клеток, приводит к образованию одноклеточного эмбриона или зиготы. В первые часы после оплодотворения два отдельных генома подвергаются событиям перепрограммирования, которые предположительно функционируют, чтобы стереть память о дифференцированном типе клеток и установить состояние тотипотентности. Механизмы, лежащие в основе тотипотентности, остаются малоизученными, хотя они обязательны для создания нового организма из оплодотворенной яйцеклетки. {Flyamer2017} Ilya M. Flyamer, Johanna Gassler, Maxim Imakaev, Hugo B. Brandão, Sergey V. Ulianov, Nezar Abdennur, Sergey V. Razin, Leonid A. Mirny, and Kikuë Tachibana-Konwalski. Single-nucleus Hi-C reveals unique chromatin reorganization at oocyte-to-zygote transition // Nature 544 (7648), 110–114 (2017). doi 10.1038/nature21711 Аннотация. Хроматин перепрограммируется после оплодотворения для получения тотипотентной зиготы с потенциалом для создания нового организма [1]. Материнский геном, унаследованный от ооцита, и отцовский геном, обеспечиваемый спермой, сосуществуют как отдельные гаплоидные ядра в зиготе. То, как эти два эпигенетически обособленных генома пространственно организованы, изучено плохо. Существующие методы фиксации конформации хромосом [2, 3, 4, 5] не применимы к ооцитам и зиготам из-за недостатка материала. Чтобы исследовать трехмерную организацию хроматина в редких типах клеток, мы разработали протокол одноядерного захвата конформации хромосом высокого разрешения (snHi-C), который обеспечивает более чем в 10 раз больше контактов на клетку, чем предыдущий метод [2]. Здесь мы показываем, что архитектура хроматина уникально реорганизуется во время перехода ооцит-зигота у мышей и отличается в отцовских и материнских ядрах в одноклеточных зиготах. Особенности геномной организации, включая компартменты, топологически ассоциирующие домены (TAD) и петли, присутствуют в отдельных ооцитах при усреднении по геному, но наличие каждого признака в локусе варьируется между клетками. На уровне менее миллиона оснований (sub-megabase) мы наблюдали стохастические кластеры контактов, которые могут встречаться через границы TAD, но в среднем в TAD (см PIT00259). Примечательно, что мы обнаружили, что TAD и петли, но не компартменты, которые присутствуют в материнском хроматине зиготы, предполагая, что они генерируются различными механизмами. Наши результаты показывают, что глобальная организация хроматина ядер зиготы принципиально отличается от структуры других интерфазных клеток. Понимание этого основного состояния хроматина зиготы может потенциально обеспечить понимание перепрограммирования клеток в состояние тотипотентности. 1. Zhou, L. Q. & Dean, J. Reprogramming the genome to totipotency in mouse embryos. Trends Cell Biol. 25, 82–91 (2015) 2. Nagano, T. et al. Single-cell Hi-C reveals cell-to-cell variability in chromosome structure. Nature 502, 59–64 (2013) 3. Ma, W. et al. Fine-scale chromatin interaction maps reveal the cis-regulatory landscape of human lincRNA genes. Nat. Methods 12, 71–78 (2015) 4. Hsieh, T.-H. S. et al. Mapping nucleosome resolution chromosome folding in yeast by micro-C. Cell 162, 108–119 (2015) 5. Barutcu, A. R. et al. C-ing the genome: a compendium of chromosome conformation capture methods to study higher-order chromatin organization. J. Cell. Physiol. 231, 31–35 (2016) Peter Belobrov 21 Apr 2017 02:20
© International Open Laboratory for Advanced Science and Technology — MOLPIT, 2009–2026
|