
|
PIT00570 Перенос инсулина везикулами (GLUT4) GLUT4 — инсулинзависимый белок-переносчик глюкозы, осуществляет перенос глюкозы, посредством облегчённой диффузии через клеточную мембрану под контролем инсулина. Содержится в отсутствии инсулина почти полностью в цитоплазме. Впервые был обнаружен в клетках жировой ткани и мышечной ткани (скелетные мышцы и миокард). Свидетельство об открытии нового глюкозного транспортёра принадлежит цитологу Дэвиду Джеймсу, который предоставил его в 1988 году [1]. Ген, кодирующий GLUT4 был клонирован [2] и картирован в 1989 [3]. Ген, кодирующий данный белок у человека — SLC2A4, расположен в 17 хромосоме. 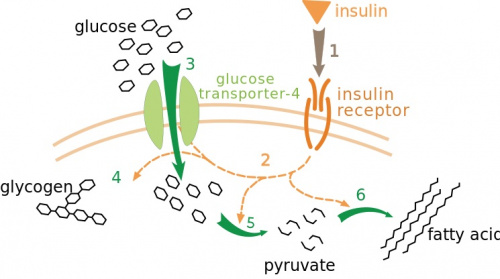 Инсулин связывается со своим рецептором, (1) что приводит к запуску нескольких киназных каскадов (2). В результате происходит перемещение транспортёра GLUT4 к плазматической мембране и вход глюкозы клетку (3), усиление синтеза гликогена (4), подавление гликолиза (5) и усиление синтеза жирных кислот (6). GLUT4 — единственный инсулинзависимый глюкозный переносчик. Недавние сообщения показали наличие гена GLUT4 в некоторых участках центральной нервной системы, таких как гиппокамп. Кроме того, ухудшение в инсулинстимулированном обороте GLUT4 в гиппокампе, может привести к снижению метаболической активности и пластичности нейронов гиппокампа, проявляющихся в депрессивных, поведенческих и когнитивных дисфункциях [4][5][6]. 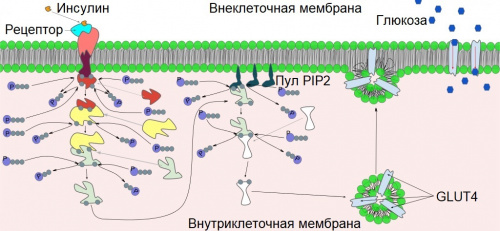 На схеме показана регуляция процесса переноса глюкозы, посредством действия инсулина на рецептор и передачи сигнала от рецептора (запуская киназные каскады, выступающие в роли вторичных мессенджеров) к GLUT4, который находится в цитоплазме в виде везикул, как только путь сигнала завершён, GLUT4 немедленно встраивается в цитоплазматическую мембрану, позволяя глюкозе пройти через его протеиновые каналы внутрь клетки. [1] James, David E., Robert Brown, Javier Navarro, and Paul F. Pilch. Insulin-regulatable tissues express a unique insulin-sensitive glucose transport protein // Nature 333, 183-185 (1988). doi 10.1038/338083a0 Аннотация В клетках млекопитающих существуют по крайней мере три различные транспортные системы глюкозы. Это: (1) конститутивно активный, облегчающий носитель, характерный для эритроцитов человека [1], клеток Hep G2 [2] и мозга крысы [3]; (2) Na-зависимый активный переносчик почек и тонкого кишечника [4,5]; и (3) облегчающий носитель печени крысы (B. Thorens и HF Lodish, личное сообщение). Четвертой возможной системой транспорта глюкозы является инсулинозависимый переносчик, который может быть специфичным для мышечной и жировой ткани [6]. Этот транспортер находится в основном во внутриклеточном компартменте покоящихся клеток, откуда он перемещается на клеточную поверхность при воздействии клеточного инсулина [7–9]. Это поднимает вопрос о том, обеспечивается ли гормональная регуляция транспорта глюкозы благодаря тканеспецифичному сигнальному механизму или тканеспецифичному переносчику глюкозы. Здесь мы представляем данные, подтверждающие последнюю концепцию, основанную на моноклональном антителе против переносчика глюкозы в жировых клетках, которое идентифицирует уникальный регулируемый инсулином транспортный белок глюкозы в мышечной и жировой ткани. Cited by 827 [2] James, David E., Marilyn Strube, and Mike Muecdler. Molecular cloning and characterization of an insulin-regulatable glucose transporter // Nature 338 (6210), 83-87 (1989). doi 10.1038/338083a0 Аннотация Здесь мы описываем клонирование и секвенирование кДНК, выделенных как из библиотек крысиных адипоцитов, так и из библиотек сердца, которые кодируют белок, распознаваемый mAb 1F8, и который имеет 65% идентичность последовательности транспортеру глюкозы HepG2 9 человека. Эта кДНК гибридизуется с мРНК, присутствующей только в скелетных мышцах, сердце и жировой ткани. Наши данные показывают, что эта кДНК кодирует мембранный белок с характеристиками транслоцируемого переносчика глюкозы, экспрессируемого в инсулиночувствительных тканях. Cited by 1127 [3] Bell, Graeme I., Jeffrey C. Murray, Yusuke Nakamura, Toshiaki Kayano, Roger L. Eddy, Yao-Shan Fan, Mary G. Byers, and Thomas B. Shows. Polymorphic human insulin-responsive glucose-transporter gene on chromosome 17p13 // Diabetes 38 (8), 1072-1075 (1989). doi 10.2337/diab.38.8.1072 Аннотация Поглощение глюкозы сердцем, скелетными мышцами и жировой тканью остро регулируется инсулином, который стимулирует облегчающий транспорт глюкозы, по крайней мере, частично, способствуя транслокации транспортеров из внутриклеточного пула на плазматическую мембрану. кДНК, кодирующие основной инсулиночувствительный переносчик глюкозы человека, были выделены и указывают на то, что инсулиночувствительный переносчик глюкозы, экспрессируемый сердцем, скелетными мышцами и жировой тканью, представляет собой белок из 509 аминокислот, имеющий 65,3, 54,3 и 57,5% идентичности с транспортеры глюкозы эритроцитов/HepG2, печени и мышц плода соответственно. Ген, кодирующий чувствительный к инсулину переносчик глюкозы (обозначенный как GLUT4) был картирован в области p11 → p13 короткого плеча хромосомы 17 человека путем анализа его сегрегации на панели редуцированных гибридов соматических клеток человека и мыши. Гибридизация in situ с прометафазными хромосомами показала, что GLUT4 находится в полосе p13. Обычный двухаллельный полиморфизм длины рестрикционных фрагментов (ПДРФ) был идентифицирован с Kpn I, и связывание этого ПДРФ с другими маркерами полиморфной ДНК в этой области хромосомы 17 обеспечивает набор зондов, которые будут полезны для изучения роли этот ген в патогенезе сахарного диабета. [4] Diaz-Vegas, Alexis, Dougall M. Norris, Sigrid Jall-Rogg, Kristen C. Cooke, Olivia J. Conway, Amber S. Shun-Shion, Xiaowen Duan et al. A high-content endogenous GLUT4 trafficking assay reveals new aspects of adipocyte biology // Life Science Alliance 6, no. 1 (2023). doi 10.26508/lsa.202201585 Аннотация Индуцированная инсулином транслокация GLUT4 на плазматическую мембрану в мышцах и адипоцитах имеет решающее значение для гомеостаза глюкозы во всем организме. В настоящее время анализы трафика GLUT4 основаны на сверхэкспрессии меченого GLUT4. Здесь мы описываем платформу визуализации с высоким содержанием для изучения эндогенной транслокации GLUT4 в интактных адипоцитах. Этот метод обеспечивает высокоточный анализ ответов GLUT4 на определенные возмущения, мультиплексирование других транспортных белков и другие особенности, включая морфологию липидных капель. Используя этот мультиплексный подход, мы показали, что Vps45 и Rab14 являются селективными регуляторами GLUT4, но Trarg1, Stx6, Stx16, Tbc1d4 и Rab10нокдаун затронул транслокацию как GLUT4, так и TfR. Таким образом, механизм транслокации GLUT4 и TfR, вероятно, имеет некоторое перекрытие при стимуляции инсулином. Кроме того, мы идентифицировали Kif13A, молекулярный мотор, связывающий Rab10, в качестве нового регулятора трафика GLUT4. Наконец, сравнение эндогенного и сверхэкспрессированного GLUT4 подчеркивает, что методология эндогенного GLUT4 обладает повышенной чувствительностью к генетическим нарушениям, и подчеркивает преимущество изучения переноса эндогенного белка для открытия лекарств и генетического анализа действия инсулина в соответствующих типах клеток. [5] Wu, Jiayi, Stella Hayoung Park, and Eunhee Choi. The insulin receptor endocytosis // Progress in Molecular Biology and Translational Science 194, 79-107 (2023). doi 10.1016/bs.pmbts.2022.06.020 Аннотация Передача сигналов инсулина контролирует множество аспектов физиологии животных. На клеточной поверхности инсулин связывается и активирует инсулиновый рецептор (ИР), рецепторную тирозинкиназу. Инсулин способствует большому конформационному изменению ИР и стабилизирует активную конформацию. Инсулин-активируемая ИР запускает сигнальные каскады, тем самым контролируя метаболизм, рост и пролиферацию. Активированный ИР подвергается интернализации посредством эндоцитоза, опосредованного клатрином или кавеолами. Эндоцитоз ИР играет важную роль в клиренсе инсулина из крови, а также в распределении и прекращении передачи сигналов инсулина. Несмотря на десятилетия обширных исследований, механизм и регуляция эндоцитоза ИР и его вклад в патофизиологию остаются не до конца изученными. [6] Matsui, Kumiko, Masahiro Emoto, Naofumi Fukuda, Ryuta Nomiyama, Kyoko Yamada, and Yukio Tanizawa. SNARE‐binding protein synaptosomal‐associated protein of 29 kDa (SNAP29) regulates the intracellular sequestration of glucose transporter 4 (GLUT4) vesicles in adipocytes // Journal of Diabetes Investigation 14 (1), 19-27 (2023). doi 10.1111/jdi.13912 Аннотация Инсулин стимулирует транслокацию переносчика глюкозы 4 (GLUT4) из перинуклеарной локализации в плазматическую мембрану. В нестимулированном состоянии внутриклеточные везикулы, содержащие GLUT4, секвестрируются в специализированные запасающие везикулы, которые стали известны как инсулиночувствительный компартмент (IRC). IRC представляет собой функциональный компартмент в околоядерной области, который является мишенью инсулинового сигнального каскада, хотя его точная природа неясна. Здесь мы сообщаем о новом молекулярном механизме, облегчающем образование IRC. Мы определили синаптосомально-ассоциированный белок 29 кДа (SNAP29) с помощью масс-спектрометрии как белок-связывающий белок 1 (EHD1), содержащий EH-домен. Затем его экспрессия была подтверждена вестерн-блоттингом. Субклеточную локализацию SNAP29 определяли с помощью иммунофлуоресцентной микроскопии. Взаимодействия между SNAP29 и синтаксинами определяли методом иммунопреципитации. Мы измерили поглощение глюкозы и транслокацию GLUT4 в адипоцитах 3T3-L1, экспрессирующих SNAP29 или подавляющих SNAP29. Мы обнаружили, что SNAP29 локализован в околоядерной области и демонстрирует частичную совместную локализацию с GLUT4 в базовых условиях. Мы также обнаружили, что SNAP29 связывается с синтаксином 6, Qc-SNARE, в адипоцитах. В клетках, экспрессирующих SNAP29, наблюдалось скопление везикул, содержащих GLUT4, вокруг перинуклеарной области. Напротив, когда SNAP29 молчал, перинуклеарные везикулы GLUT4 были рассеяны по всему цитозолю. Стимулированное инсулином поглощение глюкозы ингибировалось как в клетках, экспрессирующих SNAP29, так и в клетках, в которых SNAP29-молчащие клетки. Эти данные свидетельствуют о том, что SNAP29 изолирует и закрепляет везикулы, содержащие GLUT4, в околоядерной области и может играть роль в биогенезе околоядерной IRC. Peter Belobrov 23 May 2023 14:14
© International Open Laboratory for Advanced Science and Technology — MOLPIT, 2009–2025
|