
|
PIT00646 Нобелевская премия по химии 2025 Нобелевская премия по химии в 2025 году присуждена Сусуму Китагаве (Susumu Kitagawa), Ричарду Робсону (Richard Robson) и Омару М. Яги (Omar M. Yaghi) «за разработку металлорганических каркасов».  Susumu Kitagawa, Richard Robson and Omar M. Yaghi Они разработали новые формы молекулярных архитектур В их конструкциях ионы металлов играют роль краеугольных камней, связанных длинными органическими (углеродными) молекулами. Вместе ионы металлов и молекулы организованы в кристаллы, содержащие большие полости. Эти пористые материалы называются металлорганическими каркасами (МОК). Изменяя строительные блоки, используемые в МОК, химики могут проектировать их для захвата и хранения определенных веществ. МОК также могут управлять химическими реакциями или проводить электричество. Всё началось в 1989 году, когда Ричард Робсон экспериментировал с использованием внутренних свойств атомов по-новому. Он соединил положительно заряженные ионы меди с четырёхлучевой молекулой; эта молекула имела химическую группу, которая притягивалась к ионам меди на конце каждой из ветвей. Соединившись, они образовали упорядоченный, объёмный кристалл. Он был подобен алмазу, заполненному бесчисленными полостями. Робсон сразу осознал потенциал своей молекулярной конструкции, но она оказалась нестабильной и легко разрушалась. Однако Сусуму Китагава и Омар Яги заложили прочную основу для этого метода строительства; в период с 1992 по 2003 год они независимо друг от друга совершили ряд революционных открытий. Китагава показал, что газы могут втекать в конструкции и вытекать из них, и предсказал, что металлоорганические каркасы (МОК) можно сделать гибкими. Яги создал очень устойчивый МОК и показал, что его можно модифицировать, используя рациональную конструкцию, придавая ему новые и желаемые свойства. После новаторских открытий лауреатов химики создали десятки тысяч различных МОК Некоторые из них могут способствовать решению важнейших задач человечества, включая отделение перфторалкильных аминов от воды, разложение следов фармацевтических препаратов в окружающей среде, улавливание углекислого газа или сбор воды из воздуха пустынь. Молодёжь Биомолекулы продолжает удивлять. Не прошло и суток, как Диана Саликова написала "про металлоорганические каркасы, в которые сначала не верили", интересно и увлекательно. Для понимания сути открытия полезно прочитать Peter Belobrov 08 Oct 2025 16:45 PIT00645 Нобелевская премия по физике 2025 Нобелевская премия по физике в 2025 году присуждена Джону Кларку (John Clarke), Мишелю Х. Деворе (Michel H. Devoret) и Джону М. Мартинису (John M. Martinis) «за открытие макроскопического квантово-механического туннелирования и квантования энергии в электрической цепи».  John Clarke, Michel H. Devoret and John M. Martinis Их эксперименты на чипе продемонстрировали квантовую физику в действии Квантовая механика позволяет частице проходить сквозь барьер, используя процесс, называемый туннелированием. При большом числе частиц квантово-механические эффекты обычно становятся незначительными. Эксперименты лауреатов продемонстрировали, что квантово-механические свойства можно конкретизировать в макроскопическом масштабе. В 1984 и 1985 годах Джон Кларк, Мишель Х. Деворе и Джон М. Мартинис провели серию экспериментов с электронной цепью, построенной из сверхпроводников – компонентов, способных проводить ток без электрического сопротивления. В цепи сверхпроводящие компоненты были разделены тонким слоем непроводящего материала, устройством, известным как джозефсоновский переход. Уточняя и измеряя все различные свойства своей цепи, они смогли контролировать и исследовать явления, возникающие при пропускании через неё тока. Вместе заряженные частицы, движущиеся через сверхпроводник, составляли систему, которая вела себя так, как если бы они были единой частицей, заполняющей всю цепь. Ключевые публикации 1. M. H. Devoret, J. M. Martinis, D. Esteve, J. M. Clarke. Resonant Activation from the Zero-Voltage State of a Current-Biased Josephson Junction // Phys. Rev. Lett. 53, 1260 (1984). doi 10.1103/PhysRevLett.53.1260. Cited by 250. 2. J. M. Martinis, M. H. Devoret, J. Clarke. Energy-Level Quantization in the ZeroVoltage State of a Current-Biased Josephson Junction // Phys. Rev. Lett. 55, 1543 (1985). doi 10.1103/PhysRevLett.55.1543. Cited by 520. 3. M. H. Devoret, J. M. Martinis, J. Clarke. Measurement of Macroscopic Quantum Tunneling out of a Zero-Voltage State of a Current-Biased Josephson Junction // Phys. Rev. Lett. 55, 1908 (1985). doi 10.1103/PhysRevLett.55.1908. Cited by 581. Для понимания сути открытия полезно прочитать Peter Belobrov 07 Oct 2025 16:50 PIT00644 Нобелевская премия по биологии 2025 Нобелевская премия по физиологии и медицине в 2025 году присуждена Мэри Э. Брункоу (Mary E. Brunkow), Фреду Рамсделлу (Fred Ramsdell) и Шимону Сакагучи (Shimon Sakaguchi) «за открытия, касающиеся периферической иммунной толерантности».  Mary E. Brunkow, Fred Ramsdell and Shimon Sakaguchi Они поняли, как иммунная система контролирует сама себя Мощная иммунная система организма должна сдерживать сама себя, чтобы не атаковать собственные органы. Мэри Э. Брункоу, Фред Рамсделл и Шимон Сакагучи совершили новаторские открытия, касающиеся периферической иммунной толерантности, которая предотвращает нанесение вреда организму со стороны иммунной системы. Их открытия заложили основу для нового направления исследований и стимулировали разработку новых методов лечения, например, рака и аутоиммунных заболеваний. В 1995 году Шимон Сакагучи плыл против течения, сделав первое ключевое открытие. В то время многие исследователи были убеждены, что иммунная толерантность развивается только благодаря уничтожению потенциально опасных иммунных клеток в тимусе посредством процесса, называемого центральной толерантностью. Сакагучи показал, что иммунная система устроена сложнее, и открыл ранее неизвестный класс иммунных клеток, защищающих организм от аутоиммунных заболеваний [1]. Мэри Бранкоу и Фред Рамсделл сделали ещё одно ключевое открытие в 2001 году, представив объяснение того, почему определённая линия мышей особенно уязвима к аутоиммунным заболеваниям. Они обнаружили у мышей мутацию в гене, который они назвали Foxp3. Они также показали, что мутации в человеческом эквиваленте этого гена вызывают серьёзное аутоиммунное заболевание — IPEX [2]. Два года спустя Шимон Сакагучи смог связать эти открытия воедино. Он доказал, что ген Foxp3 управляет развитием клеток, которые он идентифицировал в 1995 году. Эти клетки, теперь известные как регуляторные Т-клетки, контролируют другие иммунные клетки и обеспечивают толерантность нашей иммунной системы к собственным тканям [3]. Они идентифицировали защитников иммунной системы – регуляторные Т-клетки, заложив тем самым основу для нового направления исследований. Эти открытия также привели к разработке потенциальных методов лечения, которые сейчас проходят клинические испытания. Цель – обеспечить возможность лечения или полного излечения аутоиммунных заболеваний, более эффективного лечения рака и предотвращения серьёзных осложнений после трансплантации стволовых клеток. Грамотный ответ на вопрос "За что вручили эту Нобелевскую премию?" сразу же написал аспирант ТИБОХ ДВО РАН Сергей Антонович Козловский. Тайны периферической иммунной регуляции на сайте "Биомолекула". Очень умное и содержательное толкование. Прочтите - не пожалеете! Ключевые публикации 1. Sakaguchi, Shimon, Noriko Sakaguchi, Masanao Asano, Misako Itoh, and Masaaki Toda. Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases // Journal of immunology (Baltimore, Md.: 1950) 155 (3), 1151-1164 (1995). doi 10.4049/jimmunol.155.3.1151. Cited by 10165 2. Brunkow, Mary E., Eric W. Jeffery, Kathryn A. Hjerrild, Bryan Paeper, Lisa B. Clark, Sue-Ann Yasayko, J. Erby Wilkinson, David Galas, Steven F. Ziegler, and Fred Ramsdell. Disruption of a new forkhead/winged-helix protein, scurfin, results in the fatal lymphoproliferative disorder of the scurfy mouse // Nature genetics 27 (1), 68-73 (2001). doi 10.1038/83784. Cited by 3665 3. Hori, Shohei, Takashi Nomura, and Shimon Sakaguchi. Control of regulatory T cell development by the transcription factor Foxp3 // Science 299 (5609), 1057-1061 (2003). doi 10.1126/science.1079490. Cited by 11699 Для понимания сути открытия полезно прочитать Peter Belobrov 06 Oct 2025 16:30 PIT00643 Передовая модель для изучения мозга Хороший обзор. Органоиды человеческого мозга: сложные, универсальные и актуальные для человека модели развития нервной системы и заболеваний мозга [1]. Аннотация Содержание статьи o Ранний эмбриогенез и развитие нервной системы o Нейроразвитие и типы клеток • Органоиды головного мозга человека: способы и типы генерации o Неуправляемые протоколы o Управляемые протоколы • Органоиды переднего мозга • Органоиды среднего мозга • Органоиды заднего мозга • Кортикальные органоиды • Хориоидальное сплетение и органоиды гиппокампа • Органоиды полосатого тела • Таламические органоиды • Гипоталамические органоиды • Органоиды гипофиза • Органоиды ствола мозга • Органоиды мозжечка • Органоиды спинного мозга • Новые стратегии o Создание органоидов человеческого мозга непосредственно из 2D культур плюрипотентных стволовых клеток o Органоиды мозга плода • Ассемблоиды o Ассемблоиды переднего мозга и глаза o Кортико-стриатные ассемблоиды o Вентральные ассемблоиды среднего мозга, полосатого тела и коры o Кортико-моторные ассемблоиды • Применение органоидов человеческого мозга o Заболевания нервной системы • Расстройство аутистического спектра • Микроцефалия o Психические расстройства • Биполярное расстройство • Шизофрения o Нейродегенеративные заболевания • болезнь Альцгеймера • Лобно-височная деменция • болезнь Паркинсона • болезнь Гентингтона o Опухоли головного мозга o Инфекционные заболевания o Трансплантация органоидов человеческого мозга o Скрининг и оценка наркотиков o Токсикологические анализы o Исследования эволюции мозга • Передовые технологии изучения клеточного разнообразия и физиологических особенностей органоидов головного мозга человека. o Васкуляризация органоидов головного мозга человека o Микроглия в органоидах головного мозга человека. o Биоинженерные подходы • Выводы [1]. Coronel, Raquel, Rosa González-Sastre, Patricia Mateos-Martínez, Laura Maeso, Elena Llorente-Beneyto, Sabela Martín-Benito, Viviana S. Costa Gagosian et al. Human cerebral organoids: Complex, versatile, and human-relevant models of neural development and brain diseases // Neural Regeneration Research 21 (3), 837-854 (2026). doi 10.4103/NRR.NRR-D-24-01639 Peter Belobrov 28 Sep 2025 02:50 PIT00642 Регенерация периферических нервов Перспектива. Периферическая нервная система и микробиота кишечника: Новые данные о расширении знаний о механизмах, позволяющие разработать инновационные стратегии регенерации периферических нервов [1]. Микробиота кишечника: организм человека населён разнообразным и сложным микробным сообществом, включающим бактерии, вирусы, археи и одноклеточные эукариоты, которое играет ключевую роль в поддержании здоровья человека. Микробиота критически важна для множества функций, включая метаболизм хозяина, физиологию, поддержание целостности эпителия кишечника, питание и иммунную функцию, что позволяет ей называться «жизненно важным органом» (Guinane and Cotter, 2013). Значительная часть этих микробов находится в желудочно-кишечном тракте: было подсчитано, что кишечник человека содержит более 100 триллионов микробных клеток, при этом микробиом содержит примерно в 100 раз больше генов, чем человеческий геном (примерно 3 миллиона генов в микробиоме человека и около 23 000 генов в геноме человека) (Rinninella et al., 2019). Доминирующими типами кишечных микробов являются Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria, Fusobacteria и Verrucomicrobia, причем Firmicutes и Bacteroidetes вместе составляют 90% кишечной микробиоты. В типе Firmicutes (грамположительные бактерии, составляющие примерно 46–58% от общего числа бактерий кишечника) род Clostridium составляет 95%, тогда как в типе Bacteroidetes (грамотрицательные бактерии, составляющие примерно 30–40% от общего числа бактерий) преобладают роды Bacteroides и Prevotella. Тип Actinobacteria менее распространён (3–7%) и представлен в основном родом Bifidobacterium (Rinninella et al., 2019). Каждый человек имеет уникальный профиль кишечной микробиоты, характеризующийся определённым сочетанием видов бактерий, на формирование которого влияют меж- и внутрииндивидуальные различия. Состав кишечной микробиоты может меняться на протяжении жизни под влиянием ряда факторов, включая географическое положение, культурные привычки, питание, физические нагрузки, образ жизни, стресс, применение или злоупотребление антибиотиками, возраст, пол, прогрессирующее ухудшение физиологических показателей и заболевания (Rinninella et al., 2019; Hou et al., 2022). Все больше данных подтверждают двунаправленную или даже многонаправленную связь между кишечной микробиотой и органами за пределами кишечника через нервные, эндокринные, гуморальные, иммунологические и метаболические пути. Следовательно, нарушения тонкого баланса хозяина и микробиома, известные как дисбактериоз, могут не только вызывать проблемы, связанные с кишечником, но и играть значительную роль в патогенезе заболеваний других органов, включая сердечно-сосудистую или дыхательную системы, заболевания головного мозга, рак и другие (Hou et al., 2022). Механизмы, посредством которых микробиота может влиять на другие органы или центральную и периферическую нервную систему (PNS), еще предстоит тщательно изучить. В настоящее время предлагаемые гипотезы включают системные эффекты высвобождения кишечных веществ, такие как секреция био- или нейроактивных метаболитов, полученных от микробиоты (Kern et al., 2024). Кроме того, взаимодействие между микробиотой кишечника и иммунной системой играет решающую роль в развитии мозга и патогенезе неврологических заболеваний (Fung et al., 2017). Ось «кишечник-периферическая нервная система»: В последние годы взаимодействие между микробиотой кишечника и энтеральной нервной системой – ветвью PNS, расположенной в стенке желудочно-кишечного тракта – было описано как при физиологических, так и при патологических состояниях (Calabrò et al., 2023). Энтеральная нервная система играет важную роль во многих физиологических процессах в желудочно-кишечном тракте и в значительной степени независима от центральной нервной системы. Её функции включают регуляцию, например, эпителиальной секреции, обмена жидкости через эпителий слизистой оболочки, барьерной функции, кровотока в кишечнике, иммунной системы и моторики кишечника. Энтеральная нервная система напрямую подвергается воздействию и взаимодействует с микробиотой кишечника и метаболитами. Появляющиеся данные свидетельствуют о том, что микробиота кишечника может оказывать существенное влияние на развитие и функцию как энтеральных нейронов, так и глиальных клеток (Calabrò et al., 2023). Совсем недавно мы исследовали потенциальное взаимодействие между микробиотой кишечника и соматической нервной системой — компонентом PNS, ответственным за произвольный контроль движений тела скелетными мышцами и за передачу соматосенсорной информации с периферии тела в мозг. 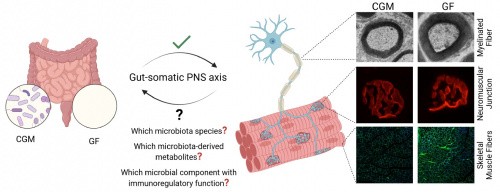 Схематическая иллюстрация, демонстрирующая текущие и будущие исследования влияния состава кишечной микробиоты на PNS и её органы-мишени. В первую очередь необходимо выявить различия между крайностями, такими как сложная кишечная микробиота и стерильные условия (как показано слева). Недавние исследования были сосредоточены на стереоморфометрии аксонов периферических нервов и двигательной ткани-мишени (как показано справа). Дальнейшие исследования будут сосредоточены на выявлении специфических составов кишечной микробиоты, в частности, связанных с ними метаболитов или микробных компонентов с иммунорегуляторными функциями (например, липополисахаридов, бактериальных капсульных полисахаридов и пептидогликана), чтобы определить, какие виды микробиоты оказывают наиболее значимое влияние на ось кишечник-соматическая система-PNS. Создано с помощью BioRender.com. CGM - сложная кишечная микробиота; GF - стерильная; PNS - периферическая нервная система. [1]. Ronchi, Giulia, Matilde Cescon, Giovanna Gambarotta, and Kirsten Haastert-Talini. Peripheral nervous system and gut microbiota: emerging evidence on increased mechanistic understanding to reveal innovative strategies for peripheral nerve regeneration // Neural Regeneration Research 21 (4), 1560-1561 (2026). doi 10.4103/NRR.NRR-D-24-01310 Peter Belobrov 28 Sep 2025 00:50
© International Open Laboratory for Advanced Science and Technology — MOLPIT, 2009–2026
|